Importancia del pH

Título de Profesora de Biología
Una de las condiciones que marcan la pauta para que los fenómenos químicos sean posibles es el pH, el cual se presenta como una característica inherente tanto de las sustancias como de los medios en sí e indica cuál es el grado de acidez o alcalinidad que puedan tener. De este modo, todas las interacciones químicas requieren un rango limitado y específico dentro de la escala de pH, para que el cumplimiento de sus funciones sea óptimo. Esta escala de valor permite cuantificar del 1 al 14 el grado ácido o básico de acción propia de cada molécula, siendo por debajo del punto medio de la escala, el área neutra de esta propiedad, por lo que las sustancias con pH por debajo de siete (7) son consideradas ácidas, mientras que las de pH por encima de dicho nivel son las básicas.
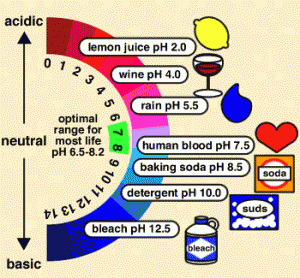
De 7 a 0, al se reconocen el jugo de limón o el vinagre (que contienen un pH de 2), el vino (pH de 4) o la lluvia (pH de 5.5), mientras nos acercamos al agua, recurso natural que posee una acidez y una alcalinidad nula, por lo cual se considera el punto medio entre los dos extremos. A contramano, el elemento con mayor nivel de acidez conocido es el ácido que se encuentra en las baterías, sustancia que posee un pH de 0, colocándose entonces al tope de la escala. Cuando pasamos el punto del agua hacia arriba, es decir de 7 a 14, encontramos los elementos o sustancias más alcalinas, las que poseen menor nivel de acidez. Una de ellas es la sangre humana, un elemento alcalino que posee un pH cercano al del agua (7.5). Dentro de las prácticas cotidianas, la mayor parte de los elementos alcalinos sirven mucho para la limpieza o desinfección, como por ejemplo limpiadores, blanqueadores, el amoníaco, el jabón. Uno de los elementos más alcalinos conocidos es el limpiador líquido para desagües que posee un pH de 14. La escala del pH es sumamente importante para conocer las características de diferentes elementos y ambientes, ya que se considera que en espacios sumamente alcalinos o sumamente ácidos no es posible la existencia de vida por la altísima o bajísima presencia de hidrógeno.
Cada quien a su gusto
 La propiedad de acidez o alcalinidad es generada por la presencia de protones de Hidrógeno en las moléculas, a mayor cantidad de protones presentes, tanto en una molécula como en una sustancia, mayor será su acidez, mientras que la alcalinidad representa la capacidad de asumir a dichos protones neutralizándolos.
La propiedad de acidez o alcalinidad es generada por la presencia de protones de Hidrógeno en las moléculas, a mayor cantidad de protones presentes, tanto en una molécula como en una sustancia, mayor será su acidez, mientras que la alcalinidad representa la capacidad de asumir a dichos protones neutralizándolos.
Las dinámicas químicas presentes en la naturaleza se encuentran completamente condicionadas a los niveles de pH en las cuales ocurren, fenómeno que también ha marcado una pauta evolutiva esencial en todos los seres vivos por medio del desarrollo de metabolismos y adaptaciones ambientales, dentro de rangos muy específicos, según el pH del medio particular en el cual haya evolucionado cada especie, convirtiéndose en un indicador ambiental con gran fragilidad, como consecuencia de la fácil alteración que puede tener – y que de hecho ha tenido – por la acción contaminante de la humanidad.
Equilibrio químico y otros detalles
Siendo que el pH se presenta como un factor determinante en el desarrollo de las reacciones químicas, todas las reacciones metabólicas resultan dependientes de éste y, además, susceptibles a sus variaciones, debido al hecho de ser, en su gran mayoría, reacciones químicas entre moléculas orgánicas dependientes de la interacción que los protones tienen entre ellas, en procesos de los cuales a su vez se terminan generando algunos subproductos de desecho denominados radicales libres.
Estas moléculas menores en tamaño, pero no en importancia, repercuten considerablemente en el nivel de pH del metabolismo, ocasionando alteraciones equiparables a las que la contaminación produce en la naturaleza, de allí la imperante necesidad de mantener un estilo de vida saludable y una alimentación balanceada, que permitan la mínima producción de radicales libres, aunado a la ingesta diaria de la suficiente cantidad de agua para la correcta eliminación de estos residuos, en modo que pueda mantenerse el normal equilibrio de todas las reacciones metabólicas, dentro del rango de pH saludable en el cual debe encontrarse nuestro organismo, de lo contrario, tanto los niveles de acidez como de alcalinidad elevados son fuente alarmante de una gran variedad de trastornos metabólicos y enfermedades, pudiendo ocasionar incluso la muerte, por lo que es indispensable comprender que bajo ninguna circunstancia se debe asumir tratamientos que conlleven a la alteración del pH en el metabolismo, sin la estricta valoración, indicación y supervisión de un médico especialista, ya que muchas han sido las personas que han terminado perdiendo la vida por consumir deliberadamente sustancias que alteraran su pH, sin siquiera estarlo necesitando y de manera completamente desproporcionada.
Naturalmente dependientes
Por otra parte, el nivel de pH del medio exterior ejerce una influencia tan poderosa sobre los organismos vivos, que una considerable perturbación de éste puede terminar afectando dramáticamente a las especies. Un ejemplo claro de este fenómeno se muestra con la alteración del pH del suelo y las nefastas consecuencias que genera en los cultivos, de allí que entre las consideraciones prioritarias para el desarrollo del cultivo se realice la experticia sobre los niveles de acidez o alcalinidad del suelo, de manera de poder aprovechar de la manera más natural posible los valores obtenidos, por medio de la selección de las plantas adecuadas a éstos, reduciendo así no solo la implementación de sustancias modificadoras del pH del suelo, y por ende el costo de producción, sino también el impacto ecológico que en general dicha intervención pudiese ocasionar.
De la misma manera, el agua tanto como fuente de vida como medio para el desarrollo de una gran variedad de especies, posee la propiedad de un pH condicionante, no obstante, por tratarse de un medio líquido que a su vez cumple con un amplio ciclo que le permite dispersarse a lo largo y ancho del planeta, se convierte en un vehículo de rápida acción también para los elementos nocivos que en ella se encuentren disueltos, haciéndose aún más grave la alteración del pH del agua como consecuencia de la presencia de factores contaminantes, haciéndose de vital importancia la ejecución de las medidas necesarias para recuperar los niveles normales en el pH de las diversas fuentes de agua afectadas por la acción humana.
Referencias
Arrieche-Luna, E., & Ruiz-Dager, M. (2010). Influencia de la fertilización química y orgánica sobre el carbono de la biomasa microbiana y rendimiento del maíz en suelos de pH contrastante. Agrociencia, 44(3), 249-260.
Cruz, G. G. Z. (2008). Una visión universitaria: el pH, sustento en el equilibrio químico para la vida celular. CienciaUAT, 2(4), 62-66.
de Andrade, J. C. (2010). Química Analítica Básica: Os conceitos ácido-base e a escala de pH. Revista Chemkeys, (1), 1-6.
Navarro, A. E., Ramos, K. P., Campos, K., Llanos, B., & Maldonado, H. J. (2005). Contribución del pH en la remoción de iones tóxicos de soluciones acuosas. Revista de Química, 19(2), 53-59.
Rakoff, H., Rose, N. C., & Jiménez, F. G. (1971). Química orgánica fundamental. Limusa.
Sadeghian, S., & Marín, C. D. (2020). Corrección de la acidez del suelo: alteraciones químicas del suelo. Revista Cenicafé, 71(1), 7-20.

Art. actualizado: Marzo 2023; sobre el original de julio, 2011.
Escriba un comentario
Contribuya con su comentario para sumar valor, corregir o debatir el tema.Privacidad: a) sus datos no se compartirán con nadie; b) su email no será publicado; c) para evitar malos usos, todos los mensajes son moderados.